Состав
действующее вещество: финеренон;
1 таблетка, покрытая пленочной оболочкой, содержит 10 мг финеренона;
1 таблетка, покрытая пленочной оболочкой, содержит 20 мг финеренона;
другие составляющие:
таблетки, покрытые пленочной оболочкой, по 10 мг: целлюлоза микрокристаллическая, кроскармелоза натрия, гипромелоза 5 cP (гидроксипропилметилцеллюлоза 2910), лактозы моногидрат, магния стеарат, натрия лаурилсульфат; пленочная оболочка: лак светло-розовый или альтернативно гипромелоза 5 cP (гидроксипропилметилцеллюлоза 2910), титана диоксид (Е 171), тальк, железа оксид красный (Е 172);
таблетки, покрытые пленочной оболочкой, по 20 мг: целлюлоза микрокристаллическая, кроскармелоза натрия, гипромелоза 5 cP (гидроксипропилметилцеллюлоза 2910), лактозы моногидрат, магния стеарат, натрия лаурилсульфат; пленочная оболочка: лак светло-желтый или альтернативно гипромелоза 5 cP (гидроксипропилметилцеллюлоза 2910), диоксид титана (Е 171), тальк, железа оксид желтый (Е 172).
Лекарственная форма
Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства:
таблетки, покрытые пленочной оболочкой, по 10 мг: розовая овально-продолговатая таблетка, покрытая пленочной оболочкой, длиной 10 мм и шириной 5 мм с маркировкой верхней стороны таблетки «10» и маркировкой нижней стороны таблетки «FI»;
таблетки, покрытые пленочной оболочкой, по 20 мг: бледно-желтая овально-продолговатая таблетка, покрытая пленочной оболочкой, длиной 10 мм и шириной 5 мм с маркировкой верхней стороны таблетки «20» и маркировкой нижней стороны таблетки «FI».
Фармакотерапевтическая группа
Средства, влияющие на сердечно-сосудистую систему. Мочегонные препараты. Антагонисты альдостерона и другие калийсберегающие средства. Антагонисты альдостерона. Финереноны.
Код ATX C03D A05.
Фармакологические свойства
Фармакодинамика.
Механизм действия
Финеренон является селективным нестероидным антагонистом минералокортикоидных рецепторов (МР), которые активируются альдостероном и кортизолом и регулируют транскрипцию генов. Его связывание с МР приводит к образованию специфического комплекса рецептор-лиганда, который блокирует привлечение коактиваторов транскрипции генов, участвующих в экспрессии провоспалительных и профиброзных медиаторов.
Фармакодинамические эффекты
В ходе рандомизированного, двойно слепого, плацебо-контролируемого, многоцентрового исследования III фазы FIDELIO-DKD и исследования FIGARO-DKD с участием взрослых пациентов с хронической болезнью почек (ХХН) и сахарным диабетом 2 типа (СД2) относительно снижение скорректированного по плацебо креатинина мочи (САК) в группе лечения финереноном составило 31% и 32% соответственно на 4 месяце и САК оставалось сниженным в течение обоих исследований.
В ходе рандомизированного, двойно слепого, плацебо-контролируемого, многоцентрового исследования IIb фазы ARTS-DN с участием взрослых пациентов с ХХН и СД2 относительное снижение скорректированного по плацебо САК на 90-й день составило 25% и 38% в группе применения финерено мг и 20 мг 1 раз в день соответственно.
Электрофизиология сердца
Специальное исследование QT с участием 57 здоровых участников показало, что финеренон не влияет на реполяризацию миокарда. Не было признаков влияния финеренона на удлинение интервала QT/QTc после приема однократных доз 20 мг (терапевтических) или 80 мг (супратерапевтических).
Клиническая эффективность и безопасность
В ходе исследований FIDELIO-DKD и FIGARO-DKD изучали влияние финеренона по сравнению с плацебо на почечные и сердечно-сосудистые (СС) показатели у взрослых пациентов с ХХН и СД2.
Пациенты получали стандартное лечение, в частности, максимальную переносимую дозу ингибитора ангиотензинпревращающего фермента (иАПФ) или блокатора рецепторов ангиотензина (БРА).
Пациенты с диагностированной сердечной недостаточностью с пониженной фракцией выброса (II–IV функциональные классы по классификации Нью-Йоркской ассоциации сердца (NYHA)) были исключены из исследования в связи с рекомендацией для класса 1А по лечению антагонистами минералокортикоидных рецепторов.
В исследовании FIDELIO-DKD пациенты включались при наличии стойкой альбуминурии (> 30 мг/г до 5000 мг/г), СКФ от 25 до 75 мл/мин/1,73 м2 и уровня калия в сыворотке крови ≤ 4,8 ммоль/л во время скрининга.
Первичной конечной точкой исследования было время до возникновения совокупности событий: первого появления почечной недостаточности (определявшейся как хронический диализ или трансплантация почки, или стойкое снижение рЖКФ до < 15 мл/мин/1,73 м2 в течение не менее 4 недель), устойчивого снижения рШКФ на 40% или больше по сравнению с исходным уровнем в течение не менее 4 недель или смерти вследствие почечной недостаточности. Ключевой вторичной конечной точкой было время до первого случая совокупности событий: смерти от СС заболеваний, нелетального инфаркта миокарда, нелетального инсульта или госпитализации по поводу сердечной недостаточности.
В общей сложности 5674 пациента были рандомизированы для получения финеренона (N = 2833) или плацебо (N = 2841) и включены в анализ. Средняя продолжительность наблюдения составила 2,6 лет. Во время исследования дозу финеренона или плацебо можно было скорректировать в пределах от 10 до 20 мг один раз в сутки, главным образом, в зависимости от концентрации калия в сыворотке крови. На 24 месяце в группе применения финеренона 67% пациентов получали 20 мг один раз в сутки, 30% - 10 мг один раз в сутки, а 3% прервали лечение.
После окончания исследования информация о жизненном статусе была получена у 99,7% пациентов. В исследуемой популяции 63% составляли представители европеоидной расы, 25% – азиаты и 5% – негроидной расы. Средний возраст пациентов при включении составлял 66 лет, 70% пациентов были мужского пола. На начальном этапе средняя рЖКФ составляла 44,3 мл/мин/1,73 м2, при этом 55% пациентов имели рШКФ < 45 мл/мин/1,73 м2, медиана САК составляла 852 мг/г, а средний уровень HbA1c составил 7 ,7%, 46% имели атеросклеротическое заболевание СС системы в анамнезе, 30% - ишемическую болезнь сердца, 8% - сердечную недостаточность, среднее артериальное давление составляло 138/76 мм рт. Средняя продолжительность СД2 в начале исследования составила 16,6 лет, а в анамнезе диабетическая ретинопатия и диабетическая нейропатии наблюдались соответственно у 47% и 26% пациентов. На начальном этапе почти все пациенты принимали иАПФ (34%) или БРА (66%), а 97% пациентов применяли один или несколько противодиабетических препаратов (инсулин [64%], бигуаниды [44%], агонисты рецепторов глюкагонообразного пептида-1 [7] %], ингибиторы натрийзависимого котранспортера глюкозы 2 типа (иНЗКТГ2) [5%]). Другими препаратами, которые чаще всего принимали в начале исследования, были статины (74%) и блокаторы кальциевых каналов (63%).
Статистически значимая разница в пользу финеренона была показана для первичной комбинированной конечной точки и ключевой вторичной комбинированной конечной точки (см. рис. 1/таблицу 1 ниже).
эффект лечения по первичным и ключевым вторичным конечным точкам в целом был одинаковым во всех подгруппах, включая рШКФ, САК, систолическое артериальное давление и HbA1c на исходном уровне.
В исследование FIGARO-DKD пациентов включали при наличии стойкой альбуминурии с САК от ≥ 30 мг/г до < 300 мг/г и рЖКФ от 25 до 90 мл/мин/1,73 м2 или САК от ≥ 300 мг/г и рШКФ ≥ 60 мл/мин/1,73 м2 во время скрининга, уровень калия в сыворотке крови пациентов должен составлять ≤4,8 ммоль/л.
Первоначальной конечной точкой было время до возникновения событий: первого случая смерти от СС заболеваний, нелетального инфаркта миокарда (ИМ), нелетального инсульта или госпитализации по поводу сердечной недостаточности. Второй конечной точкой было время до возникновения событий: появления почечной недостаточности, устойчивого снижения рЖКФ на 40% или более по сравнению с исходным уровнем в течение не менее 4 недель или смерти вследствие почечной недостаточности.
В общей сложности было рандомизировано и включено в анализ 7352 пациента для получения финеренона (N = 3686) или плацебо (N = 3666). Средняя продолжительность наблюдения составила 3,4 года. Во время лечения доза финеренона или плацебо могла быть скорректирована в пределах от 10 до 20 мг/сут, главным образом в зависимости от концентрации калия в сыворотке крови. На 24 месяце в группе применения финеренона 82% пациентов получали 20 мг один раз в сутки, 15% - 10 мг один раз в сутки, а 3% участников исследования прервали лечение.
После исследования информация о жизненном статусе была получена от 99,8% пациентов. В исследуемой популяции 72% составляли представители европеоидной расы, 20% – монголоидной и 4% – негроидной расы. Средний возраст пациентов при включении составил 64 года, 69% пациентов были мужского пола. На начальном этапе среднее значение рЖКФ составляло 67,8 мл/мин/1,73 м2, причем у 62% пациентов рШКФ была ≥ 60 мл/мин/1,73 м2, медиана САК составляла 308 мг/г, а средний уровень HbA1c 7,7%; 45% участников имели в анамнезе атеросклеротическое поражение сердечно-сосудистой системы, 8% - сердечную недостаточность, а среднее артериальное давление составило 136/77 мм рт. ст. Средняя продолжительность заболевания СД2 в начале исследования составила 14,5 года, а диабетическая ретинопатия и диабетическая невропатия в анамнезе были зарегистрированы соответственно у 31 и 28% пациентов. На начальном этапе почти все пациенты применяли ингибиторы АПФ (43%) или БРА (57%), а 98% пациентов применяли один или несколько противодиабетических препаратов (инсулин [54%], бигуаниды [69%], агонисты рецепторов глюкагонообразного пептида-1 [ 7%], ИНЗКТГ2 [8%]). Другими препаратами, которые чаще всего принимали в начале исследования, были статины (71%).
Статистически значимая разница в пользу финеренона была показана для сердечно-сосудистой первичной комбинированной конечной точки (см. рисунок 1 и таблицу 2 ниже). Эффект лечения для первичной конечной точки был аналогичным в разных подгруппах, в частности стратифицированных по региону, рЖКФ, САК, систолическим АД и HbA1c на исходном уровне.
В группе финеренона по сравнению с плацебо наблюдалась более низкая частота достижения последствий вторичной комбинированной конечной точки в виде появления почечной недостаточности, устойчивого снижения рЖКФ на 40% и более или смерти вследствие почечной недостаточности, однако эта разница не достигала статистической значимости (см. таблицу 2). Эффект лечения для почечной вторичной комбинированной конечной точки был аналогичен различным подгруппам по РЖКФ на исходном уровне, однако для подгруппы пациентов с САК < 300 мг/г относительный риск (ВР) составил 1,16 (95% доверительный интервал (ДИ) 0,91 ; 1,47), а для подгруппы пациентов с САК ≥ 300 мг/г ВР составлял 0,74 (95% ДИ 0,62; 0,90).
Дополнительные предварительно определенные вторичные конечные точки времени до события включены в таблицу 2.
Таблица 1
Анализ первичных и вторичных конечных точек времени до события (и их отдельных компонентов) в исследовании III фазы FIDELIO-DKD
|
Показник
|
Фириалта* (N = 2833)
|
Плацебо (N = 2841)
|
Лечебный эффект
|
|
N (%)
|
события/ 100 пациенто-лет
|
N (%)
|
события/ 100 пациенто-лет
|
Соотношение рисков
(95 % ДІ)
|
|
Первичная почечная комбинированная конечная точка и ее компоненты
|
|
Совокупность событий почечной недостаточности, стойкого снижения рЖКФ ≥ 40% или смерти вследствие почечной недостаточности
|
504 (17,8 %)
|
7,59
|
600 (21,1 %)
|
9,08
|
0,82 (0,73;0,93)
р = 0,0014
|
|
Почечная недостаточность
|
208 (7,3 %)
|
2,99
|
235 (8,3 %)
|
3,39
|
0,87 (0,72; 1,05)
|
|
Устойчивое снижение рЖКФ ≥ 40%
|
479 (16,9 %)
|
7,21
|
577 (20,3 %)
|
8,73
|
0,81 (0,72; 0,92)
|
|
Смерть в результате почечной недостаточности
|
2 (< 0,1 %)
|
-
|
2 (< 0,1 %)
|
-
|
-
|
|
Ключевая вторичная СС комбинированная конечная точка и ее компоненты
|
|
Совокупность событий смерти вследствие СС заболевания, нелетального ИМ, нелетального инсульта или госпитализации вследствие сердечной недостаточности
|
367 (13,0 %)
|
5,11
|
420 (14,8 %)
|
5,92
|
0,86 (0,75; 0,99)
р = 0,0339
|
|
Смерть в результате СС заболевания
|
128 (4,5 %)
|
1,69
|
150 (5,3 %)
|
1,99
|
0,86 (0,68; 1,08)
|
|
Нелетальный ИМ
|
70 (2,5 %)
|
0,94
|
87 (3,1 %)
|
1,17
|
0,80 (0,58; 1,09)
|
|
Нелетальный инсульт
|
90 (3,2 %)
|
1,21
|
87 (3,1 %)
|
1,18
|
1,03 (0,76; 1,38)
|
|
Госпитализация вследствие сердечной недостаточности
|
139 (4,9 %)
|
1,89
|
162 (5,7 %)
|
2,21
|
0,86 (0,68; 1,08)
|
|
Вторичная конечная точка эффективности
|
|
Смерть по каким-либо причинам
|
219 (7,7 %)
|
2,90
|
244 (8,6 %)
|
3,23
|
0,90
(0,75; 1,07)**
|
|
Госпитализация по любым причинам
|
1 263 (44,6 %)
|
22,56
|
1 321 (46,5 %)
|
23,87
|
0,95
(0,88; 1,02)**
|
|
Совокупность событий почечной недостаточности, стойкого снижения рЖКФ ≥ 57% или смерти вследствие почечной недостаточности
|
252 (8,9 %)
|
3,64
|
326 (11,5 %)
|
4,74
|
0,76
(0,65; 0,90)**
|
* Терапия с применением 10 или 20 мг один раз в сутки в дополнение к максимальным переносимым дозам ингибиторов АПФ или БРА.
** p не является статистически значимым после корректировки на кратность.
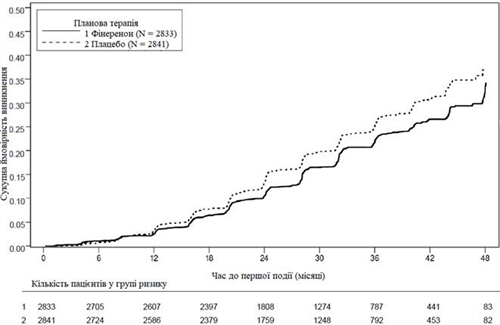
Рис. 1. Время до первого возникновения почечной недостаточности, устойчивого снижения рЖКФ ≥ 40% исходного уровня или смерти вследствие почечной недостаточности в исследовании FIDELIO-DKD.
Таблица 2
Анализ первичных и вторичных конечных точек времени до события (и их отдельных компонентов) в исследовании III фазы FIGAROO-DKD
|
Показатель
|
Фириалта* (N = 3686)
|
Плацебо (N = 3666)
|
Лечебный эффект
|
|
N (%)
|
события/ 100 пациенто-лет
|
N (%)
|
события/ 100 пациенто-лет
|
Соотношение рисков
(95 % ДІ)
|
|
Первичная СС комбинированная конечная точка и ее компоненты
|
|
Совокупность событий смерти вследствие СС заболевания, нелетального ИМ, нелетального инсульта или госпитализации вследствие сердечной недостаточности
|
458 (12,4)
|
3,87
|
519 (14,2)
|
4,45
|
0,87 (0,76; 0,98)
p = 0,0264
|
|
Смерть в результате СС заболевания
|
194 (5,3)
|
1,56
|
214 (5,8)
|
1,74
|
0,90 (0,74; 1,09)
|
|
Нелетальный ИМ
|
103 (2,8)
|
0,85
|
102 (2.8)
|
0,85
|
0,99 (0,76; 1,31)
|
|
Нелетальный инсульт
|
108 (2,9)
|
0,89
|
111 (3,0)
|
0,92
|
0,97 (0,74; 1,26)
|
|
Госпитализация вследствие сердечной недостаточности
|
117 (3,2)
|
0,96
|
163 (4,4)
|
1,36
|
0,71 (0,56; 0,90)
|
|
Вторичная почечная комбинированная конечная точка и ее компоненты
|
|
Совокупность событий почечной недостаточности, стойкого снижения рЖКФ ≥ 40% или смерти в результате почечной недостаточности
|
350 (9,5)
|
3,15
|
395 (10,8)
|
3,58
|
0,87 (0,76; 1,01) p = 0,0689 **
|
|
Почечная недостаточность
|
46 (1,2)
|
0,40
|
62 (1,7)
|
0,54
|
0,72 (0,49;1,05)
|
|
Устойчивое снижение рЖКФ ≥ 40%
|
338 (9,2)
|
3,04
|
385 (10,5)
|
3,49
|
0,87 (0,75; > 1,00)
|
|
Смерть в результате почечной недостаточности
|
0
|
-
|
2 (< 0,1)
|
-
|
-
|
|
Вторичная конечная точка эффективности
|
|
Смерть по каким-либо причинам
|
333 (9,0)
|
2,68
|
370 (10,1)
|
3,01
|
0,89 (0,77; 1,04)**
|
|
Госпитализация по любым причинам
|
1573 (42,7)
|
16,91
|
1605 (43,8)
|
17,52
|
0,97 (0,90; 1,04)**
|
|
Совокупность событий почечной недостаточности, стойкого снижения рЖКФ ≥ 57% или смерти вследствие почечной недостаточности
|
108 (2,9)
|
0,95
|
139 (3,8)
|
1,23
|
0,77 (0,60; 0,99)**
|
* Терапия с применением 10 или 20 мг один раз в сутки в дополнение к максимальным переносимым дозам ингибиторов АПФ или БРА.
** p не является статистически значимым после корректировки на кратность.
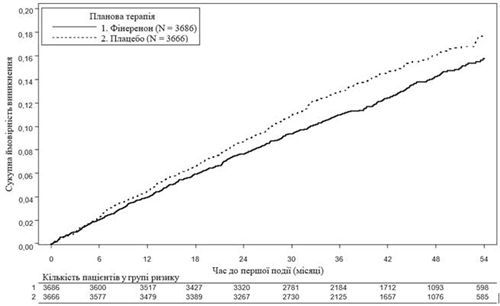
Рис. 2. Время до первого случая смерти от СС заболеваний, нелетального ИМ, нелетального инсульта или госпитализации в результате сердечной недостаточности в исследовании FIGARO-DKD.
Педиатрические пациенты
Европейское агентство по лекарственным средствам отложило обязательство по представлению результатов исследований препарата Фириалта в одной или нескольких подгруппах педиатрической популяции при лечении хронической болезни почек (для получения информации о применении в педиатрии см. способ применения и дозы).
Фармакокинетика.
Абсорбция
Финеренон почти полностью всасывается после приема внутрь. Всасывание происходит быстро, максимальная концентрация в плазме крови (Cₘₐₓ) достигается через 0,5–1,25 ч после приема таблетки натощак. Абсолютная биодоступность финеренона составляет 43,5% благодаря метаболизму первого прохождения в стенках кишечника и печени. Финеренон in vitro является субстратом транспортера оттока Р-гликопротеина, который, однако, не считается релевантным для его поглощения in vivo из-за высокой проницаемости финеренона.
Воздействие приема пищи. Прием пищи с высоким содержанием жиров и высокой калорийности повышал AUC финеренона на 21%, уменьшал Cₘₐₓ на 19% и продлевал время достижения Cₘₐₓ до 2,5 часов. Поскольку это не считается клинически значимым, финеренон можно принимать независимо от еды.
Распределение
Объем распределения в равновесном состоянии (Vₛₛ) финеренона составляет 52,6 л. Связывание финеренона с белками плазмы крови человека in vitro составляет 91,7%, при этом сывороточный альбумин является основным связывающим белком.
Биотрансформация
Приблизительно 90% метаболизма финеренона опосредуется CYP3A4 и 10% - CYP2C8. В плазме были обнаружены четыре основных метаболита. Все метаболиты фармакологически неактивны.
Вывод
Выведение финеренона из плазмы происходит быстро, период полувыведения составляет примерно от 2 до 3 часов. Системный клиренс финеренона в крови составляет примерно 25 л/ч. Около 80% введенной дозы выводилось с мочой и около 20% - с калом. Выведение происходило почти исключительно в форме метаболитов, тогда как экскреция неизмененного финеренона является второстепенным путем (< 1% дозы с мочой вследствие клубочковой фильтрации, < 0,2% с калом).
Линейность
Фармакокинетика финеренона линейна в исследованном диапазоне доз от 1,25 до 80 мг таблеток, назначенных в однократной дозировке.
Особые группы пациентов
Пациенты пожилого возраста. Из 2827 пациентов, получавших финеренон в исследовании FIDELIO-DKD, 58% были в возрасте от 65 лет, а 15% – от 75 лет. Из 3683 пациентов, получавших финеренон в исследовании FIGARO-DKD, 52% были в возрасте от 65 лет, а 13% – от 75 лет. В общем, различий в безопасности или эффективности финеренона у этих пациентов и пациентов младшего возраста не наблюдалось в обоих исследованиях.
В исследовании I фазы (N = 48) здоровые участники пожилого возраста (≥ 65 лет) имели более высокие концентрации финеренона в плазме, чем младшие здоровые участники (≤ 45 лет), при этом средние значения AUC и Cₘₐₓ были на 34% и 51% выше у пациентов пожилого возраста (см. «Способ применения и дозы»). Популяционно-фармакокинетический анализ не определил возраст как ковариата для AUC или Cₘₐₓ финеренона.
Нарушение функции почек. Нарушение функции почек легкой степени (клиренс креатинина (КлКр) от 60 до < 90 мл/мин) не влиял на AUC и Cₘₐₓ финеренона. По сравнению с пациентами с нормальной функцией почек (КлКр ≥ 90 мл/мин) влияние почечной недостаточности умеренной (КлКр от 30 до < 60 мл/мин) и тяжелой (КлКр < 30 мл/мин) степени на AUC финеренона было сходным с увеличением на 34–36%. Нарушение функции почек умеренной или тяжелой степени не влияло на Cₘₐₓ (см. раздел «Способ применения и дозы»).
Из-за высокого уровня связывания с белками плазмы не ожидается, что финеренон подлежит диализу.
Нарушение функции печени. Экспозиция финеренона у пациентов с циррозом и легким поражением печени не изменялась (см. раздел «Способ применения и дозы»).
У пациентов с циррозом печени с умеренной степенью нарушения функции печени по сравнению со здоровыми участниками контрольной группы общая AUC финеренона и AUC несвязанного финеренона увеличивались на 38% и 55% соответственно, тогда как изменений Cₘₐₓ не наблюдалось (см. раздел «Способ» »).
Данных пациентов с тяжелой степенью нарушения функции печени нет (см. раздел «Способ применения и дозы» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Масса тела. Популяционно-фармакокинетический анализ определил массу тела как ковариата для Cₘₐₓ финеренона. У пациента с массой тела 50 кг по сравнению с пациентом, масса тела которого 100 кг, Cₘₐₓ оценивается выше на 38–51 %. Коррекция дозы в зависимости от массы тела не оправдана (см. «Способ применения и дозы»).
Фармакокинетические/фармакодинамические взаимосвязи
Взаимосвязь «концентрация-эффект» для показателя соотношения альбумина и креатинина в моче (САК) в зависимости от времени была охарактеризована моделью максимального эффекта, указывающей на насыщение при большой экспозиции. Прогнозируемое моделью время достижения полного (99%) эффекта лекарственного средства в равновесном состоянии на САК составляло 138 дней. Фармакокинетический (ФК) период полувыведения составлял 2–3 часа, а ФК равновесное состояние достигалось через 2 дня, что указывает на косвенное и отсроченное влияние на фармакодинамические эффекты.
Клинические исследования без существенных взаимодействий между лекарственными средствами
Одновременное применение гемфиброзила (600 мг дважды в сутки), сильного ингибитора CYP2C8, повышало среднюю AUC и Cₘₐₓ финеренона в 1,1 и 1,2 раза соответственно. Это не считается клинически значимым.
Предшествующая и сопутствующая терапии ингибитором протонной помпы омепразолом (40 мг один раз в сутки) не влияли на среднюю AUC и среднюю Cₘₐₓ финеренона.
Одновременное применение антацида гидроксида алюминия и гидроксида магния (70 мВал) не влияло на среднюю AUC финеренона и снижало среднее значение Cₘₐₓ на 19%. Это не считается клинически значимым.
In vivo режим многократного приема 20 мг финеренона один раз в сутки в течение 10 дней не оказывал существенного влияния на AUC субстрата CYP3A4 мидазолама. Таким образом, можно исключить клинически значимое угнетение или индукцию CYP3A4 финереноном.
Однократная доза 20 мг финеренона также не оказывала клинически значимого влияния на AUC и Cₘₐₓ репаглинида, субстрата CYP2C8. Следовательно, финеренон не ингибирует CYP2C8.
Было продемонстрировано отсутствие фармакокинетического взаимодействия между финереноном и субстратом CYP2C9 варфарином и между финереноном и субстратом P-gp дигоксином.
Многократные дозы финеренона 40 мг один раз в сутки не оказывали клинически значимого влияния на AUC и Cₘₐₓ розувастатина, субстрата белка резистентности рака молочной железы и органического анионтранспортного полипептида.
Доклинические данные по безопасности
Доклинические данные не выявили особого риска для человека на основе общепринятых исследований фармакологической безопасности, токсичности разовой дозы, токсичности повторных доз, генотоксичности, фототоксичности, канцерогенного потенциала и влияния на фертильность у мужчин и женщин.
Показання
Лекарственное средство Фириалта показано для лечения хронической болезни почек (с альбуминурией), связанной с сахарным диабетом 2 типа, у взрослых.
Результаты исследований по почечным и сердечно-сосудистым событиям см. в разделе "Фармакодинамика".
Противопоказания
Повышенная чувствительность к действующему веществу или любому из вспомогательных веществ.
Одновременное применение с сильными ингибиторами CYP3A4 (см. Взаимодействие с другими лекарственными средствами и другие виды взаимодействий), например с итраконазолом, кетоконазолом, ритонавиром, нелфинавиром, кобицистатом, кларитромицином, телитромицином, нефазодоном. Болезнь Аддисона.
Взаимодействие с другими лекарственными средствами
Исследования взаимодействия проводились только с участием взрослых пациентов.
Финеренон выводится почти исключительно с помощью окислительного метаболизма, опосредованного цитохромом P450 (CYP) (в основном CYP3A4 [90%] с небольшим вкладом CYP2C8 [10%]).
Одновременное применение противопоказано
Сильные ингибиторы CYP3A4
Противопоказано одновременное применение лекарственного средства Фириалта с итраконазолом, кларитромицином и другими сильными ингибиторами CYP3A4 (например кетоконазолом, ритонавиром, нелфинавиром, кобицистатом, телитромицином или нефазодоном) (см. раздел «Противопоказания»).
Одновременное применение не рекомендовано
Сильные и умеренные индукторы CYP3A4
Не следует применять лекарственное средство Фириалта одновременно с рифампицином и другими сильными индукторами CYP3A4 (например, с карбамазепином, фенитоином, фенобарбиталом, зверобоем) или с эфавирензом и другими умеренными индукторами CYP3A4. Предполагается, что эти индукторы CYP3A4 заметно снизят концентрацию финеренона в плазме крови и приведут к снижению терапевтического эффекта (см. раздел «Особенности применения»).
Некоторые лекарственные средства, повышающие уровень калия в сыворотке крови
Не следует применять лекарственное средство Фириалта одновременно с калийсберегающими диуретиками (например с амилоридом, триамтереном) и другими антагонистами минералокортикоидных рецепторов (например, эплеренон, эсаксеренон, спиронолактон, канренон). Предполагается, что эти лекарственные средства повышают риск развития гиперкалиемии (см. раздел «Особенности применения»).
Грейпфрут
Грейпфрут или грейпфрутовый сок не следует употреблять во время терапии финереноном, поскольку ожидается, что это приведет к увеличению концентрации финеренона в плазме крови за счет
угнетение CYP3A4 (см. раздел «Способ применения и дозы» и «Особенности применения»).
Одновременное применение с оговорками
Умеренные ингибиторы CYP3A4
В клиническом исследовании одновременное применение эритромицина (500 мг трижды в сутки) приводило к 3,5-кратному увеличению AUC финеренона и 1,9-кратному увеличению его Cₘₐₓ. В другом клиническом исследовании верапамил (таблетки с контролируемым высвобождением по 240 мг 1 раз в сутки) привел к увеличению AUC и Cₘₐₓ финеренона в 2,7 и 2,2 раза соответственно.
Уровень калия в сыворотке крови может повышаться, поэтому рекомендуется контролировать уровень калия в сыворотке крови, особенно при начале или изменении дозы финеренона или ингибитора CYP3A4 (см. раздел «Способ применения и дозы» и «Особенности применения»).
Слабые ингибиторы CYP3A4
Фармакокинетическое физиологически обоснованное моделирование показывает, что флувоксамин (100 мг дважды в сутки) увеличивает AUC финеренона (в 1,6 раза) и Cₘₐₓ (в 1,4 раза).
Уровень калия в сыворотке крови может повышаться, поэтому рекомендуется контролировать уровень калия в сыворотке крови, особенно в начале терапии или в случае изменения дозы финеренона или ингибитора CYP3A4 (см. раздел «Способ применения и дозы» и «Особенности применения»).
Некоторые лекарственные средства, которые повышают уровень калия в сыворотке крови (см. раздел «Особенности применения»)
Ожидается, что одновременное применение лекарственного средства Фириалта с препаратами калия и триметопримом или триметопримом/сульфаметоксазолом повысит риск гиперкалиемии. Необходимо контролировать уровень калия в сыворотке крови.
Может потребоваться временное прекращение приема лекарственного средства Фириалта во время лечения триметопримом или триметопримом/сульфаметоксазолом.
Антигипертензивные лекарственные средства
Риск артериальной гипотензии увеличивается при одновременном применении нескольких других антигипертензивных лекарственных средств. Таким пациентам рекомендуется контроль АД.
Особенности по применению
Гиперкалиемия
У пациентов, получавших терапию финереноном, наблюдалась гиперкалиемия (см. раздел «Побочные реакции»).
Некоторые пациенты имеют более высокий риск развития гиперкалиемии.
Факторы риска включают низкую рЖКФ, высокий уровень калия в сыворотке крови и предыдущие эпизоды гиперкалиемии. Следует рассмотреть возможность более частого наблюдения за состоянием пациентов.
Начало и продолжение терапии (см. «Способ применения и дозы»)
Если уровень калия в сыворотке крови > 5,0 ммоль/л, не следует начинать терапию финереноном.
Если уровень калия в сыворотке крови > 4,8–5,0 ммоль/л, может быть рассмотрено начало терапии финереноном с дополнительным контролем уровня калия в сыворотке крови в течение первых 4 недель в зависимости от характеристик пациента и уровня калия в сыворотке крови.
Если уровень калия в сыворотке > 5,5 ммоль/л, лечение финереноном следует приостановить. Необходимо соблюдать стандартные рекомендации по лечению гиперкалиемии.
Как только уровень калия в сыворотке крови будет составлять ≤ 5,0 ммоль/л, лечение финереноном можно восстановить в дозировке 10 мг один раз в день.
Контроль
Повторно измеряют уровень калия в сыворотке крови и рЖКФ у всех пациентов через 4 недели после начала терапии, восстановления терапии или увеличения дозы финеренона. После этого следует периодически и при необходимости оценивать уровень калия в сыворотке крови в зависимости от характеристик пациента и уровня калия в сыворотке крови (см. способ применения и дозы).
Сопутствующая терапия
Риск гиперкалиемии также может увеличиваться при одновременном приеме лекарственных средств, которые могут повышать содержание калия в сыворотке крови (см. Взаимодействие с другими лекарственными средствами и другие виды взаимодействий). См. раздел См. также «Одновременное применение веществ, влияющих на экспозицию финеренона».
Не следует одновременно применять финеренон из:
калийсберегающими диуретиками (например, амилорид, триамтерен) и
другими антагонистами минералокортикоидных рецепторов ((АМКР), например эплеренон, эсаксеренон, спиронолактон, канренон).
С осторожностью применяют финеренон и контролируют уровень калия в сыворотке крови при одновременном приеме:
препаратами калия;
триметопримом или триметопримом/сульфаметоксазолом. Может потребоваться временное прекращение приема финеренона.
Нарушение функции почек
Риск гиперкалиемии возрастает при понижении функции почек. При необходимости следует проводить постоянный контроль функции почек в соответствии со стандартной практикой (см. «Способ применения и дозы»).
Начало терапии
Не следует начинать терапию финереноном пациентам с рЖКФ < 25 мл/мин/1,73 м2, поскольку клинические данные ограничены (см. раздел «Способ применения и дозы» и «Фармакокинетика»).
Продолжение терапии
Терапию финереноном следует прекратить у пациентов, у которых почечная недостаточность прогрессировала до терминальной стадии (рККФ < 15 мл/мин/1,73 м2), поскольку клинические данные ограничены.
Нарушение функции печени
Не следует начинать терапию финереноном пациентам с тяжелой печеночной недостаточностью (см. Способ применения и дозы). Применение препарата этим пациентам не изучалось (см. Фармакокинетика), но ожидается значительное увеличение экспозиции финеренона.
Применение финеренона пациентам с умеренной печеночной недостаточностью может потребовать дополнительного контроля в связи с увеличением экспозиции финеренона. Следует рассмотреть возможность дополнительного контроля уровня калия в сыворотке крови и адаптацию мониторинга в соответствии с характеристиками пациента (см. раздел «Способ применения и дозы» и «Фармакокинетика»).
Сердечная недостаточность
Пациенты с диагностированной сердечной недостаточностью с пониженной фракцией выброса (II–IV функциональные классы по классификации Нью-Йоркской ассоциации сердца (NYHA)) были исключены из клинических исследований III фазы (см. Фармакодинамика).
Одновременное применение веществ, влияющих на экспозицию финеренона
Умеренные и слабые ингибиторы CYP3A4
Следует контролировать уровень калия в сыворотке крови при одновременном применении финеренона с умеренными или слабыми ингибиторами CYP3A4 (см. раздел «Способ применения и дозы» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Сильные и умеренные индукторы CYP3A4
Не следует одновременно применять финеренон с сильными или умеренными индукторами CYP3A4 (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Грейпфрут
Грейпфрут или грейпфрутовый сок не следует употреблять при лечении финереноном. (см. разделы "Способ применения и дозы" и "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Эмбриофетальная токсичность
Финеренон не следует применять во время беременности, за исключением случаев, когда тщательно взвешены польза для матери и риски для плода. Если женщина забеременела при применении финеренона, ее следует проинформировать о потенциальных рисках для плода.
Женщинам репродуктивного возраста следует рекомендовать использовать эффективную контрацепцию при терапии финереноном.
Женщинам следует рекомендовать прекратить грудное вскармливание во время терапии финереноном.
Дополнительную информацию см. в разделах "Применение в период беременности или кормления грудью" и "Доклинические данные по безопасности".
Информация о вспомогательных веществах
Лекарственное средство Фириалта содержит лактозу
Пациентам с редкими наследственными заболеваниями, например с непереносимостью галактозы, дефицитом лактазы или нарушением всасывания глюкозы-галактозы, не следует принимать это лекарственное средство.
Лекарственное средство Фириалта содержит натрий
Это лекарственное средство содержит менее 1 ммоль натрия (23 мг) на таблетку, то есть практически свободно от натрия.
Применение в период беременности или кормления грудью.
Контрацепция у женщин
Женщинам репродуктивного возраста следует использовать эффективную контрацепцию во время терапии финереноном (см. раздел «Особенности применения»).
Беременность
Нет данных о применении финеренона беременными женщинами.
Исследования на животных показали репродуктивную токсичность.
Лекарственное средство Фириалта не следует применять во время беременности, за исключением случаев, когда клиническое состояние женщины нуждается в лечении финереноном. Если женщина забеременела при приеме финеренона, ее следует проинформировать о потенциальных рисках для плода (см. раздел «Особенности применения»).
Кормление грудью
Неизвестно, выделяется ли финеренон или его метаболиты с грудным молоком.
Доступные фармакокинетические/токсикологические данные показали экскрецию финеренона и его метаболитов в молоко у животных. У крыс, подвергшихся влиянию лекарственного средства этим путем, наблюдались побочные явления. Существование риска для новорожденных/младенцев нельзя исключать.
Следует принять решение о прекращении кормления грудью или отказа от терапии финереноном с учетом пользы грудного вскармливания для ребенка и пользы терапии для женщины (см. раздел «Особенности применения»).
Фертильность
Нет данных о влиянии финеренона на фертильность у человека.
Исследования на животных показали снижение фертильности самок при экспозициях, превышающих максимальные экспозиции у человека, имеющего низкую клиническую значимость.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Лекарственное средство Фириалта не влияет на быстроту реакции при управлении автотранспортом или другими механизмами.
Способ приминения и дозы
Дозировка
Рекомендуемая доза составляет 20 мг финеренона один раз в день.
Максимальная рекомендуемая доза составляет 20 мг финеренона один раз в день.
Начало терапии
Необходимо измерить уровень калия в сыворотке крови и рЖКФ, чтобы определить, можно ли начать лечение финереноном и вычислить начальную дозу.
Если уровень калия в сыворотке крови ≤ 4,8 ммоль/л, можно приступить к терапии финереноном. Для контроля уровня калия в сыворотке крови см. ниже "Продолжение терапии".
Если уровень калия в сыворотке крови > 4,8–5,0 ммоль/л, можно рассмотреть начало терапии финереноном с дополнительным контролем уровня калия в сыворотке крови в течение первых 4 недель в зависимости от характеристик пациента и уровня калия в сыворотке крови (см. раздел « Особенности применения»).
Если уровень калия в сыворотке крови > 5,0 ммоль/л, то терапию финереноном не следует начинать (см. раздел «Особенности применения»).
Рекомендуемая начальная доза финеренона базируется на рККФ и представлена в таблице 3.
Таблица 3
Начало терапии финереноном и рекомендуемая доза
|
рШКФ (мл/хв/1,73 м2)
|
Начальная доза (один раз в день)
|
|
≥ 60
|
20 мг
|
|
≥ 25 до < 60
|
10 мг
|
|
< 25
|
не рекомендуется
|
Продолжение терапии
Через 4 недели после начала или восстановления терапии финереноном или увеличения дозы необходимо повторно измерить уровень калия и рЖКФ в сыворотке крови (см. таблицу 4 для определения продолжения терапии финереноном и коррекции дозы).
После этого необходимо периодически и при необходимости измерять уровень калия в сыворотке крови в зависимости от характеристик пациента и уровня калия в сыворотке крови.
Дополнительную информацию см. в разделах «Особенности применения» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий».
Таблица 4
Продолжение терапии финереноном и корректировка дозы
|
|
Текущая доза финеренона (один раз в день)
|
|
10 мг
|
20 мг
|
|
Текущий уровень калия в сыворотке крови (ммоль/л)
|
≤ 4,8
|
Повысить до 20 мг финеренона один раз в день*
|
Поддерживать дозировку 20 мг один раз в день
|
|
> 4,8 до 5,5
|
Поддерживать дозировку 10 мг один раз в день
|
Поддерживать дозировку 20 мг один раз в день
|
|
> 5,5
|
Приостановить применение финеренона.
Возможность восстановления терапии в дозе 10 мг 1 раз в день следует рассмотреть при уровне калия в сыворотке крови ≤5,0 ммоль/л.
|
Приостановить применение финеренона.
Восстановление терапии в дозе 10 мг 1 раз в день при уровне калия в сыворотке крови ≤5,0 ммоль/л.
|
* Поддерживать дозировку 10 мг один раз в сутки, если рЖКФ снизится > 30% по сравнению с предыдущим измерением
Пропущенная доза
Пропущенную дозу следует принять, как только пациент упомянет, но только в тот же день.
Пациент не должен принимать 2 дозы, чтобы компенсировать пропущенную дозу.
Особые группы пациентов
Пациенты пожилого возраста
Коррекция дозы пациентам пожилого возраста не требуется (см. раздел Фармакокинетика).
Нарушение функции почек
Начало лечения
Пациентам с рЖКФ < 25 мл/мин/1,73 м2 терапию финереноном не следует начинать из-за ограниченных клинических данных (см. разделы «Особенности применения» и «Фармакокинетика»).
Продолжение лечения
Пациентам с рЖКФ ≥ 15 мл/мин/1,73 м2 терапию финереноном можно продолжить с корректировкой дозы в зависимости от уровня калия в сыворотке крови. рЖКФ следует измерить через 4 недели после начала терапии, чтобы определить, можно ли повысить начальную дозу до рекомендуемой суточной дозы 20 мг (см. Дозирование, продолжение терапии и таблицу 4).
Из-за ограниченных клинических данных терапию финереноном следует прекратить пациентам, у которых почечная недостаточность прогрессировала до терминальной стадии (рККФ < 15 мл/мин/1,73 м2) (см. раздел «Особенности применения»).
Нарушение функции печени
Пациенты с
тяжелой печеночной недостаточностью:
не следует приступать к применению финеренона (см. разделы «Особенности применения» и «Фармакокинетика»). Нет данных по применению.
умеренной печеночной недостаточностью:
Коррекция начальной дозы не требуется. Следует рассмотреть дополнительный контроль уровня калия в сыворотке крови и адаптировать контроль в соответствии с характеристиками пациента (см. разделы «Особенности применения» и «Фармакокинетика»).
легкой печеночной недостаточностью:
Коррекция начальной дозы не требуется.
Сопутствующая терапия
Для пациентов, принимающих финеренон одновременно с умеренными или слабыми ингибиторами CYP3A4, препаратами калия, триметопримом или триметопримом/сульфаметоксазолом, следует рассмотреть дополнительный контроль уровня калия в сыворотке крови и адаптацию контроля в соответствии с характеристиками пациента (см. особенности применения). Решение о терапии финереноном следует принимать в соответствии с указаниями в таблице 4 («Дозировка, продолжение терапии»).
Может потребоваться временное прекращение применения финеренона, если пациентам приходится принимать триметоприм или триметоприм/сульфаметоксазол. Дополнительную информацию см. в разделах «Особенности применения» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий».
Масса тела
Коррекция дозы в зависимости от массы тела не требуется (см. раздел Фармакокинетика).
Способ применения
Применять перорально.
Таблетки можно принимать, запивая стаканом воды, независимо от еды (см. раздел «Фармакокинетика»).
Таблетки не следует принимать с грейпфрутом или соком грейпфрута (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Измельчение таблеток
Пациентам, которые не могут проглотить целые таблетки, таблетки лекарственного средства Фириалта можно измельчить и смешать с водой или мягкой пищей, например с яблочным пюре непосредственно перед пероральным приемом (см. раздел «Фармакокинетика»).
Дети.
Безопасность и эффективность применения финеренона детям (до 18 лет) пока не установлены. Данные отсутствуют.
Передозировка
Наиболее вероятным проявлением передозировки, как ожидается, будет гиперкалиемия. Если развивается гиперкалиемия, следует начать стандартное лечение.
Маловероятно, что финеренон будет эффективно выводиться с помощью гемодиализа, поскольку его фракция связывания с белками плазмы крови составляет примерно 90%.
Побочные эффекты
Резюме профиля безопасности
Наиболее частой побочной реакцией, наблюдавшейся при терапии лекарственным средством Фириалта, была гиперкалиемия (≥14%), см. «Гиперкалиемия» ниже и раздел «Особенности применения».
Безопасность применения лекарственного средства Фириалта пациентам с хронической почечной болезнью и сахарным диабетом 2 типа оценивали в ходе 2 ключевых исследований III фазы FIDELIO-DKD (диабетическая болезнь почек) и FIGARO-DKD. В исследовании FIDELIO-DKD 2827 пациентов получали финеренон (10 или 20 мг один раз в день), а 2831 – плацебо. Средняя продолжительность лечения составила 2,2 года. В исследовании FIGARO-DKD 3683 пациенты получали финеренон (10 или 20 мг один раз в сутки) со средней продолжительностью лечения 2,9 года.
Побочные реакции, о которых сообщалось, приведены в таблице 5 в соответствии с системой MedDRA по классам систем органов и частотой возникновения.
Побочные реакции сгруппированы в соответствии с их частотой в порядке уменьшения серьезности. Частота определяется как очень часто (≥ 1/10), часто (≥ 1/100 до < 1/10), редко (≥ 1/1000 до < 1/100), редко (≥ 1/10000 до < 1/1000) , очень редко (< 1/10000), неизвестно (нельзя оценить по имеющимся данным).
Таблица 5
Побочные реакции
|
MedDRA
Система органов
|
Очень часто
|
Часто
|
Нечасто
|
|
Нарушение обмена веществ и питания
|
Гиперкалиемия
|
Гипонатриемия, гиперурикемия
|
|
|
Сосудистые нарушения
|
|
Артериальная гипотензия
|
|
|
Патология кожи и подкожной клетчатки
|
|
Зуд
|
|
|
Результаты исследований
|
|
Снижение скорости клубочковой фильтрации
|
Снижение уровня гемоглобина
|
Описание отдельных побочных реакций
Гиперкалиемия
В объединенных данных исследований FIDELIO-DKD и FIGARO-DKD гиперкалиемия была зарегистрирована у 14% пациентов, получавших финеренон, по сравнению с 6,9% пациентов, получавших плацебо. На первом месяце лечения в группе финеренона по сравнению с группой плацебо наблюдалось повышение среднего уровня сывороточного калия на 0,17 ммоль/л по отношению к начальному уровню, который в дальнейшем оставался стабильным. У пациентов, получавших финеренон, большинство случаев гиперкалиемии были от легкой до умеренной степени и прошли. О серьезных случаях гиперкалиемии сообщалось чаще при применении финеренона (1,1%), чем при применении плацебо (0,24%). Концентрации калия в сыворотке > 5,5 ммоль/л и > 6,0 ммоль/л были зарегистрированы у 16,8% и 3,3% пациентов, получавших финеренон, и у 7,4% и 1,24% пациентов, получавших плацебо, соответственно.
Гиперкалиемия, приведшая к окончательному прекращению лечения, у пациентов, получавших финеренон, составила 1,7% против 0,6% в группе плацебо. Частота госпитализации из-за гиперкалиемии в группе финеренона составила 0,9% против 0,2% в группе плацебо.
Для получения конкретных рекомендаций см. См. раздел «Способ применения и дозы» и «Особенности применения».
Артериальная гипотензия
В объединенных данных исследований FIDELIO-DKD и FIGARO-DKD артериальная гипотензия была зарегистрирована у 4,6% пациентов, получавших финеренон, по сравнению с 3,04% пациентов, получавших плацебо. У 3 пациентов (< 0,1%) лечение финереноном было окончательно прекращено из-за артериальной гипотензии. Частота госпитализации из-за артериальной гипотензии была одинаковой в группе финеренона и в группе плацебо (< 0,1%).
У пациентов, получавших финеренон, большинство случаев артериальной гипотензии были легкой или умеренной и прошли.
Среднее систолическое АД снизилось на 2–4 мм рт. ст., а среднее диастолическое АД снизилось на 1–2 мм рт. ст. через 1 месяц, оставаясь стабильным в дальнейшем.
Гиперурикемия
В объединенных данных исследований FIDELIO-DKD и FIGARO-DKD явления гиперурикемии наблюдались у 5,1% пациентов, получавших финеренон, по сравнению с 3,9% пациентов, получавших плацебо. Ни одно из явлений не было оценено как серьезное и не привело к окончательному прекращению применения финеренона пациентами. В группе финеренона по сравнению с группой плацебо к 16 месяцу наблюдалось повышение среднего уровня мочевой кислоты на 0,3 ммоль/дл по отношению к исходному уровню, этот уровень со временем снизился. Не было никакой разницы между группами финеренона и плацебо относительно сообщений о явлениях подагры (3,0 %).
Сниженная скорость клубочковой фильтрации (СКФ)
В объединенных данных исследований FIDELIO-DKD и FIGARO-DKD снижение СКФ было зарегистрировано у 5,3% пациентов, принимавших финеренон, по сравнению с 4,2% пациентов, получавших плацебо. У пациентов, получавших финеренон, снижение СКФ, что приводило к окончательному прекращению приема препарата, было таким же, как у пациентов группы плацебо (0,2%). Частота госпитализации из-за снижения СКФ была одинаковой в группе финеренона и в группе плацебо (<0,1%).
У пациентов, получавших финеренон, большинство случаев снижения СКФ были легкой или умеренной степени и прошли.
У пациентов, получавших финеренон, отмечено начальное снижение СКФ (в среднем на 2 мл/мин/1,73 м2), которое со временем уменьшилось по сравнению с соответствующим показателем в группе применения плацебо. Это понижение оказалось обратимым во время непрерывного лечения.
Снижение уровня гемоглобина
В объединенных данных исследований FIDELIO-DKD и FIGARO-DKD применение финеренона было связано с абсолютным снижением среднего уровня гемоглобина, скорректированным за плацебо, на 0,154 г/дл и среднего гематокрита на 0,5% через 4 месяца терапии. Частота случаев анемии сравнима у пациентов, принимавших финеренон (6,5%), и у пациентов, получавших плацебо (6,1%). Частота серьезных случаев анемии была низкой у пациентов, получавших финеренон, и у пациентов, получавших плацебо (0,5%). Изменения уровней гемоглобина и гематокрита были временными и соответствовали значениям, наблюдавшимся в группе, получавшей плацебо, примерно через 24–32 месяца.
Сообщения о подозреваемых побочных реакциях.
Сообщение о побочных реакциях после регистрации лекарственного средства имеет важное значение. Это позволяет проводить мониторинг соотношения польза/риск при применении этого лекарственного средства. Медицинским и фармацевтическим работникам, а также пациентам или их законным представителям следует сообщать о всех случаях подозреваемых побочных реакций и отсутствии эффективности лекарственного средства через Автоматизированную информационную систему по фармаконадзора по ссылке: https://aisf.dec.gov.ua.
Срок годности
3 года.
Условия хранения
Не требует специальных условий хранения. Хранить в недоступном для детей месте.
Упаковка
Таблетки, покрытые плёночной оболочкой, по 10 мг: по 14 таблеток в блистере; по 2 или 7 блистеров с календарной шкалой в картонной пачке.
Таблетки, покрытые плёночной оболочкой, по 20 мг: по 14 таблеток в блистере; по 2 или 7 блистеров с календарной шкалой в картонной пачке.
Категория отпуска
Производитель
Байер АГ.
Местонахождение производителя и его адрес места осуществления деятельности.
Кайзер-Вильгельм-Алее, 51368, Леверкузен, Германия.
Медикаменты
БАД и витамины
Медицинские товары
Антибиотики
Товары для мам и детей
Косметика и гигиена