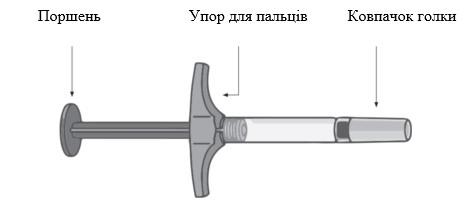
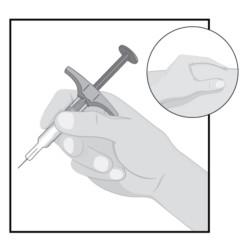
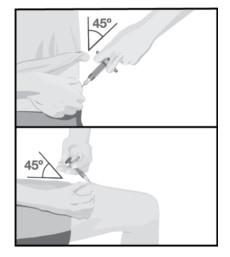
Можливість відстежування
З метою покращення контролю застосування біологічних препаратів необхідно чітко фіксувати торговельну назву та номер серії введеного препарату.
Інфекції
Пацієнти, які приймають антагоністи ФНП, більш сприйнятливі до серйозних інфекцій. Порушення функції легенів може збільшити ризик розвитку інфекцій. Тому пацієнти повинні перебувати під ретельним наглядом щодо інфекцій, включаючи туберкульоз, до, під час і після лікування лікарським засобом Хуміра®. Оскільки виведення адалімумабу може тривати до чотирьох місяців, моніторинг слід продовжувати протягом цього періоду.
Не слід застосовувати лікарський засіб Хуміра® пацієнтам з активним інфекційним процесом, включаючи хронічні або локалізовані інфекції, поки інфекція не буде контрольована. У пацієнтів, які мають контакт із хворим на туберкульоз або повернулися з країн з високим рівнем захворюваності на туберкульоз або з ендемічних зон щодо мікозів, таких як гістоплазмоз, кокцидіоїдомікоз або бластомікоз, слід оцінити співвідношення користь/ризик до початку застосування лікарського засобу Хуміра® (див. нижче «Інші опортуністичні інфекції»).
Необхідно провести повне обстеження та ретельно спостерігати за станом пацієнтів, у яких під час лікування лікарським засобом Хуміра® розвинулася нова інфекція. Слід припинити лікування при розвитку тяжкої інфекції або сепсису та застосувати відповідні протимікробні або протигрибкові препарати, поки інфекція не буде контрольована. Лікарям слід бути обережними при розгляді питання про призначення лікарського засобу Хуміра® пацієнтам з рецидивуючими інфекціями в анамнезі або з фоновими станами (включаючи супутнє застосування імуносупресивних препаратів), які можуть бути причиною схильності пацієнтів до інфекцій.
Тяжкі інфекції
Повідомлялося про серйозні інфекції, включаючи сепсис, спричинені бактеріальними, мікобактеріальними, інвазивними грибковими, паразитарними, вірусними або іншими опортуністичними інфекціями, такими як лістеріоз, легіонельоз та пневмоцистоз, у пацієнтів, які отримували лікарський засіб Хуміра®.
Інші серйозні інфекції, виявлені під час клінічних випробувань, включають пневмонію, пієлонефрит, септичний артрит і септицемію. Повідомлялося про госпіталізацію або летальні наслідки, пов’язані з інфекціями.
Туберкульоз
Повідомлялося про випадки реактивації та про розвиток нової інфекції туберкульозу, включаючи легеневу та нелегеневу форми (тобто дисемінований туберкульоз), у пацієнтів, які отримували лікування препаратом Хуміра®.
До початку терапії лікарським засобом Хуміра® пацієнтів потрібно ретельно обстежити щодо активного та неактивного (латентного) туберкульозу. Обстеження повинно включати вичерпну оцінку анамнезу пацієнта з туберкульозом або відомості про можливі контакти з хворими на активний туберкульоз і про попередню та/або супутню імуносупресивну терапію. Слід провести всім пацієнтам до початку терапії шкірний туберкуліновий тест (проба Манту) та рентгенографію грудної клітки (можуть застосовуватися місцеві рекомендації). Рекомендується, щоб проведення та результати цих тестів були записані в інформаційну картку пацієнта. Лікарям, які призначають препарати, слід пам’ятати про ризик хибно негативних результатів туберкулінових шкірних проб, особливо у тяжкохворих пацієнтів або у пацієнтів з ослабленим імунітетом.
Терапію лікарським засобом Хуміра® не слід проводити, якщо діагностується активний туберкульоз (див. розділ «Протипоказання»).
У всіх ситуаціях, описаних нижче, слід дуже ретельно оцінювати співвідношення користь/ризик терапії.
Якщо є підозра на прихований туберкульоз, слід проконсультуватися з лікарем, який має досвід лікування туберкульозу.
У разі діагностики латентного туберкульозу перед початком терапії лікарським засобом Хуміра® потрібно провести специфічне протитуберкульозне профілактичне лікування відповідно до місцевих рекомендацій.
Слід зважити на необхідність застосування протитуберкульозного лікування перед початком терапії лікарським засобом Хуміра® пацієнтам, які мають фактори ризику розвитку туберкульозної інфекції, але в яких отримано негативний результат тесту на латентний туберкульоз, та пацієнтам, які мали в анамнезі латентний або активний туберкульоз і для яких не може бути підтверджене відповідне лікування.
Незважаючи на профілактичне протитуберкульозне лікування, випадки реактивації туберкульозу траплялися у пацієнтів, які отримували препарат Хуміра®. На тлі лікування лікарським засобом Хуміра® у деяких пацієнтів, які раніше перенесли успішну терапію активного туберкульозу, спостерігався повторний розвиток туберкульозу.
Усіх пацієнтів потрібно попередити про необхідність консультації лікаря у разі появи ознак, що нагадують симптоми туберкульозу (наприклад, постійний кашель, зменшення маси тіла, субфебрильна температура, апатія) під час або після лікування лікарським засобом Хуміра®.
Інші опортуністичні інфекції
Протягом терапії лікарським засобом Хуміра® повідомлялося про розвиток опортуністичних інфекцій, у тому числі інвазивних грибкових інфекцій. Іноді такі інфекції своєчасно не діагностувалися у пацієнтів, які приймали антагоністи ФНП, що призводило до пізнього початку відповідного лікування та іноді завершувалося летально.
Пацієнти, які застосовують блокатори ФНП, більш схильні до розвитку серйозних грибкових інфекцій, таких як гістоплазмоз, кокцидіоїдомікоз, бластомікоз, аспергільоз, кандидоз тощо. Терапію лікарським засобом Хуміра® потрібно негайно припинити, якщо у пацієнта спостерігається розвиток лихоманки, нездужання, зменшення маси тіла, підвищення пітливості, поява кашлю, задишки та/або інфільтратів у легенях або інших ознак серйозного системного захворювання (з шоком або без), та слід запідозрити інвазивну грибкову інфекцію. Рішення щодо застосування емпіричної протигрибкової терапії таким хворим слід приймати після консультації з фахівцем у сфері діагностики та лікування інвазивних грибкових інфекцій.
Реактивація гепатиту В
Випадки реактивації гепатиту В траплялись у пацієнтів, які приймали блокатори ФНП та були хронічними носіями вірусу гепатиту В (ВГВ), тобто в яких було виявлено поверхневий антиген вірусу. Деякі випадки були летальними. Перед початком лікування препаратом Хуміра® пацієнти повинні пройти тест на наявність ВГВ-інфекції. Пацієнтам з позитивним тестом на ВГВ-інфекцію рекомендується проконсультуватися з лікарем, який має досвід лікування гепатиту В.
Носії ВГВ, які потребують терапії лікарським засобом Хуміра®, повинні перебувати під ретельним наглядом щодо появи ознак і симптомів активної ВГВ-інфекції під час терапії та протягом кількох місяців після її припинення. Немає адекватних даних щодо лікування пацієнтів, які є носіями ВГВ, противірусними препаратами в поєднанні з антагоністами ФНП для запобігання реактивації ВГВ. Пацієнтам, у яких розвивається реактивація ВГВ, слід припинити прийом лікарського засобу Хуміра® та розпочати ефективну противірусну терапію з відповідним підтримуючим лікуванням.
Неврологічні розлади
При застосуванні блокаторів ФНП, у тому числі лікарського засобу Хуміра®, повідомлялося про поодинокі випадки появи або загострення клінічних симптомів та/або радіографічних ознак демієлінізуючих захворювань центральної нервової системи, включаючи розсіяний склероз, неврит зорового нерва та демієлінізуючі захворювання периферичної нервової системи, включаючи синдром Гійєна – Барре. Лікарі, які призначають препарат, повинні з обережністю розглядати можливість застосування лікарського засобу Хуміра® пацієнтам із демієлінізуючими розладами центральної або периферичної нервової системи, які спостерігалися раніше або нещодавно виникли; необхідно припинити терапію лікарським засобом Хуміра® у разі виникнення зазначених розладів. Відомо, що існує зв’язок між інтермедіарним увеїтом та демієлінізуючими розладами центральної нервової системи. Неврологічне обстеження необхідно проводити пацієнтам з неінфекційним інтермедіарним увеїтом перед тим, як розпочати терапію лікарським засобом Хуміра®, та регулярно протягом терапії, щоб оцінювати розвиток демієлінізуючих розладів центральної нервової системи, які спостерігалися раніше чи нещодавно виникли.
Алергічні реакції
Під час клінічних досліджень серйозні алергічні реакції, пов’язані з лікарським засобом Хуміра®, виникали рідко. Несерйозні алергічні реакції, пов’язані з прийомом лікарського засобу Хуміра®, під час клінічних досліджень були нечастими.
Повідомлялося про серйозні алергічні реакції, включаючи анафілаксію, після введення лікарського засобу Хуміра®. При виникненні анафілактичної реакції або іншої серйозної алергічної реакції необхідно негайно припинити застосування лікарського засобу Хуміра® і розпочати відповідну терапію.
Імуносупресія
Під час клінічних досліджень лікарського засобу Хуміра® у 64 пацієнтів з РА випадків пригнічення гіперчутливості сповільненого типу, зниження рівнів імуноглобулінів або кількісних змін ефекторних Т- та В-клітин, а також NK-клітин, моноцитів/макрофагів та нейтрофілів не спостерігалося.
Злоякісні новоутворення та лімфопроліферативні захворювання
У контрольованих клінічних дослідженнях блокаторів ФНП частіше повідомлялося про розвиток злоякісних новоутворень, включаючи лімфому, у пацієнтів, які отримували ФНП-блокатор, ніж у пацієнтів контрольної групи. Проте явище було рідкісним. У постреєстраційний період повідомлялося про випадки лейкемії у пацієнтів, які отримували антагоністи ФНП. Існує підвищений фоновий ризик розвитку лімфоми і лейкемії у пацієнтів з ревматоїдним артритом із тривалим перебігом та високоактивним запальним процесом, що ускладнює оцінку ризику. Дані, що існують на сьогодні, не дають змоги виключити ризик розвитку лімфоми, лейкемії та інших злоякісних новоутворень у пацієнтів, які отримують антагоністи ФНП.
У постреєстраційний період повідомлялося про окремі випадки розвитку злоякісних новоутворень, іноді з летальним наслідком, у дітей, підлітків та дорослих пацієнтів молодого віку (до 22 років), які отримували лікування блокаторами ФНП (початок терапії у віці ≤ 18 років), включаючи адалімумаб. Приблизно в половині цих випадків злоякісними новоутвореннями були лімфоми. Інші випадки були представлені різними видами злоякісних новоутворень, зокрема такими, що зазвичай пов’язані з імуносупресією. Не можна виключити ризик розвитку злоякісних новоутворень у дітей та підлітків, які отримують антагоністи ФНП.
У постреєстраційний період у пацієнтів, які застосовували адалімумаб, дуже рідко повідомлялося про розвиток гепатолієнальної Т-клітинної лімфоми. Цей рідкісний тип лімфоми характеризується дуже агресивним перебігом та зазвичай є летальним. Деякі з цих випадків гепатолієнальної Т-клітинної лімфоми на фоні прийому лікарського засобу Хуміра® траплялися у дорослих пацієнтів молодого віку, які отримували супутню терапію азатіоприном або 6-меркаптопурином для лікування запальних захворювань кишечнику. Потенційний ризик одночасного застосування азатіоприну або 6-меркаптопурину з лікарським засобом Хуміра® має бути ретельно оцінений. Ризик розвитку гепатолієнальної Т-клітинної лімфоми у пацієнтів, які приймають лікарський засіб Хуміра®, не можна виключати (див. розділ «Побічні реакції»).
Досліджень щодо застосування лікарського засобу Хуміра® пацієнтам зі злоякісними новоутвореннями в анамнезі або щодо продовження терапії лікарським засобом Хуміра® пацієнтів, в яких розвинулося злоякісне новоутворення, не проводилося. Це потрібно враховувати та з обережністю приймати рішення щодо призначення лікарського засобу Хуміра® таким хворим (див. розділ «Побічні реакції»).
У всіх пацієнтів, особливо у пацієнтів з інтенсивною імуносупресивною терапією в анамнезі та у пацієнтів із псоріазом, яким проводили PUVA-терапію, слід виключити наявність немеланомного раку шкіри до та протягом періоду застосування лікарського засобу Хуміра®. Також повідомлялось про випадки меланоми та карциноми з клітин Меркеля у пацієнтів, що отримували лікування антагоністами ФНП, включаючи адалімумаб (див. розділ «Побічні реакції»).
У пошуковому клінічному дослідженні, в якому оцінювали застосування іншого ФНП-блокатора (інфліксимаб), у пацієнтів із хронічним обструктивним захворюванням легень (ХОЗЛ) середнього та тяжкого ступеня повідомлялося про більш часті випадки виникнення новоутворень, здебільшого у легенях, голові та на ділянці шиї, порівняно з контрольною групою. Всі пацієнти довгий час були курцями. Тому необхідно з обережністю застосовувати будь-які ФНП-блокатори пацієнтам із хронічною обструктивною хворобою легень та пацієнтам із підвищеним ризиком виникнення новоутворень на тлі паління.
Дотепер невідомо, чи впливає застосування адалімумабу на ризик розвитку дисплазії або раку кишечнику. Усі пацієнти з виразковим колітом, що входять до групи підвищеного ризику розвитку дисплазії або раку кишечнику (наприклад пацієнти з довготривалим виразковим колітом або первинним склерозуючим холангітом), або ті, хто мав в анамнезі дисплазію або рак кишечнику, повинні підлягати регулярному обстеженню щодо наявності дисплазії перед початком терапії та протягом перебігу всієї хвороби. Обстеження має включати колоноскопію та біопсію відповідно до місцевих рекомендацій.
Гематологічні розлади Рідко при застосуванні блокаторів ФНП повідомлялося про розвиток панцитопенії, включаючи апластичну анемію. При застосуванні лікарського засобу Хуміра® повідомлялося про побічні реакції з боку системи крові, включаючи клінічно значущу цитопенію (наприклад тромбоцитопенію, лейкопенію). Усіх пацієнтів потрібно попередити про необхідність негайної консультації лікаря при появі симптомів, притаманних захворюванням крові (таких як постійна гарячка, синці, кровотеча, блідість шкіри та слизових оболонок), на тлі застосування лікарського засобу Хуміра®. Слід розглянути необхідність припинення застосування лікарського засобу Хуміра® у разі підтвердження у пацієнта серйозних порушень з боку крові. Вакцинація
При проведенні дослідження за участю 226 дорослих пацієнтів з ревматоїдним артритом, які отримували лікування адалімумабом або плацебо, була отримана подібна гуморальна відповідь на стандартну 23-валентну пневмококову вакцину та тривалентну вакцину проти вірусу грипу. Даних щодо вторинної передачі інфекції пацієнтам, які отримували живі вакцини та лікарський засіб Хуміра®, немає.
Для пацієнтів дитячого віку рекомендовано провести всі необхідні щеплення, якщо це можливо, згідно з календарем до початку терапії лікарським засобом Хуміра®.
Застосування живих вакцин (наприклад БЦЖ-вакцина) немовлятам, які піддавалися впливу адалімумабу внутрішньоутробно, не рекомендується протягом 5 місяців після останньої ін’єкції адалімумабу матері у період вагітності.
Хронічна серцева недостатність (ХСН)
У клінічних дослідженнях з іншим блокатором ФНП повідомлялося про погіршення перебігу ХСН та підвищену смертність, пов’язану із ХСН. Повідомлялося також про випадки погіршення перебігу ХСН у пацієнтів, які отримують терапію лікарським засобом Хуміра®. Лікарський засіб Хуміра® слід з обережністю застосовувати пацієнтам із серцевою недостатністю легкого ступеня (I/II клас згідно з NYHA). Хуміра® протипоказана пацієнтам із ХСН середнього та тяжкого ступеня (див. розділ «Побічні реакції»). Лікування лікарським засобом Хуміра® необхідно припинити у разі виникнення у пацієнта нових або погіршення наявних симптомів хронічної серцевої недостатності у пацієнта.
Аутоімунні процеси
Лікування лікарським засобом Хуміра® може спричинити появу аутоантитіл. Вплив тривалого застосування лікарського засобу Хуміра® на розвиток аутоімунних захворювань невідомий. Якщо після початку терапії лікарським засобом Хуміра® виникають симптоми, що нагадують вовчакоподібний синдром, а також позитивні результати аналізу на антитіла до дволанцюгової ДНК, лікування лікарським засобом Хуміра® необхідно припинити.
Одночасне застосування з біологічними DMARDs або з антагоністами ФНП
Спостерігалися серйозні інфекції під час клінічних досліджень супутнього застосування анакінри та іншого антагоніста ФНП – етанерцепту, що не мало терапевтичних переваг у порівнянні з монотерапією етанерцептом. З огляду на характер побічних явищ, що спостерігалися під час комбінованого лікування етанерцептом та анакінрою, подібна токсичність може розвинутися при комбінації анакінри та іншого блокатора ФНП. Тому комбінація адалімумабу та анакінри не рекомендується.
Одночасне застосування адалімумабу з іншими біологічними DMARDs (наприклад, анакінра та абатацепт) або з іншими антагоністами ФНП не рекомендується з огляду на можливе підвищення ризику інфекцій та інших потенційних фармакологічних взаємодій (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Хірургічні втручання
Доступні обмежені дані щодо безпеки хірургічних процедур для пацієнтів, які отримують лікарський засіб Хуміра®. Тривалий період напіввиведення адалімумабу необхідно брати до уваги, якщо планується хірургічне втручання. Пацієнта, який потребує хірургічного втручання та знаходиться на лікуванні лікарським засобом Хуміра®, потрібно ретельно обстежити на наявність інфекцій та вжити необхідних заходів. Доступні обмежені дані щодо безпеки застосування пацієнтам, які піддавались артропластиці під час терапії лікарським засобом Хуміра®.
Непрохідність тонкої кишки
Відсутність відповіді на лікування хвороби Крона може свідчити про наявність фіксованої фіброзної стриктури, яка вимагає лікування хірургічним шляхом. Доступні дані дають змогу вважати, що лікування лікарським засобом Хуміра® не спричиняє виникнення або прогресування стриктур.
Пацієнти літнього віку
Частота розвитку серйозних інфекцій у пацієнтів віком від 65 років, які отримували лікарський засіб Хуміра®, (3,7 %), вища, ніж у молодших пацієнтів (1,5 %). Деякі випадки були летальними. При лікуванні пацієнтів літнього віку особливу увагу слід приділити оцінці ризику виникнення інфекцій.
Діти Див. підрозділ «Вакцинація» вище.
Застосування у період вагітності або годування груддю. Жінки репродуктивного віку
Для запобігання вагітності жінки репродуктивного віку повинні користуватися надійними методами контрацепції під час лікування та протягом щонайменше п’яти місяців після введення останньої дози препарату Хуміра®.
Вагітність
В результаті проспективного аналізу даних щодо застосування адалімумабу під час вагітності (приблизно 2100 випадків вагітностей, які завершилися народженням живих дітей з відомими наслідками, у тому числі понад 1500 випадків застосування препарату у першому триместрі) не виявлено збільшення частоти виникнення вад розвитку у новонароджених.
В проспективний когортний реєстр було включено 257 жінок з РА або ХК, які отримували адалімумаб як мінімум протягом першого триместру, та 120 жінок з РА або ХК, які не отримували адалімумаб. Первинною кінцевою точкою була частота розвитку значних вроджених вад у новонароджених. Частота випадків вагітностей, які завершилися народженням принаймні однієї живої дитини зі значною вродженою вадою, становила 6 з 69 (8,7 %) в групі жінок з РА, які отримували адалімумаб, та 5 з 74 (6,8 %) – в групі жінок з РА, які не застосовували препарат (нескориговане відношення шансів [ВШ] – 1,31, 95 % довірчий інтервал [ДІ] – 0,38–4,52). В групі жінок з ХК, які отримували адалімумаб, частота таких випадків становила 16 з 152 (10,5 %), а в групі жінок з ХК, які не застосовували препарат, відповідно 3 з 32 (9,4 %) (нескориговане ВШ – 1,14, 95 % ДІ – 0,31–4,16). В об’єднаній групі жінок з РА та ХК скориговане ВШ (з поправкою на відмінності на вихідному рівні) становило 1,10 (95 % ДІ – 0,45–2,73). Між жінками, які застосовували та не застосовували адалімумаб, не було виявлено чітко виражених відмінностей щодо вторинних кінцевих точок у вигляді спонтанних абортів, незначних вроджених вад, передчасних пологів, маси тіла та зросту новонароджених і серйозних або опортуністичних інфекцій, а також не було зареєстровано випадків мертвонародження або розвитку злоякісних пухлин. На інтерпретацію даних могли впливати методологічні обмеження дослідження, у тому числі малий об’єм вибірки та нерандомізований дизайн дослідження.
В експериментальному дослідженні токсичності на мавпах не було виявлено ознак токсичної дії на материнський організм, а також ембріотоксичної та тератогенної дії. Доклінічні дані щодо постнатальної токсичності адалімумабу відсутні.
Оскільки адалімумаб інгібує ФНП-α, його застосування під час вагітності може порушити нормальні імунні реакції у новонародженого. Вагітним жінкам слід застосовувати адалімумаб лише у разі очевидної необхідності.
Адалімумаб може проникати через плаценту в сироватку крові новонароджених, матері яких отримували адалімумаб під час вагітності. Тому у таких новонароджених може бути підвищений ризик інфікування. Застосування живих вакцин (наприклад вакцини БЦЖ) немовлятам, що піддавалися впливу адалімумабу внутрішньоутробно, не рекомендується протягом 5 місяців після останньої ін'єкції адалімумабу матері у період вагітності.
Годування груддю
Обмежені опубліковані дані свідчать про те, що адалімумаб екскретується у грудне молоко у дуже низьких концентраціях – від 0,1 % до 1 % рівня у сироватці матері. З огляду на те, що білки імуноглобуліну G піддаються в кишечнику протеолізу і мають низьку біодоступність, системний вплив адалімумабу на немовлят, які знаходяться на грудному вигодовуванні, малоймовірний. Отже, препарат Хуміра® можна застосовувати в період годування груддю.
Фертильність
Доклінічні дані щодо впливу адалімумабу на фертильність відсутні.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Хуміра® може мати незначний вплив на швидкість реакції при керуванні автотранспортом або іншими механізмами. Застосування лікарського засобу Хуміра® може спричинити виникнення вертиго та порушення гостроти зору (див. розділ «Побічні реакції»).
Медикаменти
БАДи і Вітаміни
Медичні товари
Антибіотики
Товари для мам і дітей
Косметика та гігієна