Фармакодинаміка.
Механізм дії
Фінеренон є нестероїдним селективним антагоністом мінералокортикоїдних рецепторів (МР), які активуються альдостероном і кортизолом та регулюють транскрипцію генів. Його зв’язування з МР призводить до утворення специфічного комплексу рецептор-ліганд, який блокує залучення коактиваторів транскрипції генів, що беруть участь у експресії прозапальних і профіброзних медіаторів.
Фармакодинамічні ефекти
У ході рандомізованого, подвійно сліпого, плацебо-контрольованого, багатоцентрового дослідження III фази FIDELIO-DKD та дослідження FIGARO-DKD за участю дорослих пацієнтів із хронічною хворобою нирок (ХХН) та цукровим діабетом 2 типу (ЦД2) відносне зниження скоригованого за плацебо співвідношення альбуміну до креатиніну сечі (САК) у групі лікування фінереноном становило 31 % та 32 % відповідно на 4-му місяці та САК залишалося зниженим протягом обох досліджень.
У ході рандомізованого, подвійно сліпого, плацебо-контрольованого, багатоцентрового дослідження IIb фази ARTS-DN за участю дорослих пацієнтів із ХХН та ЦД2 відносне зниження скоригованого за плацебо САК на 90-й день становило 25 % і 38 % у групі застосування фінеренону в дозі 10 мг і 20 мг один раз на день відповідно.
Електрофізіологія серця
Спеціальне дослідження QT за участю 57 здорових учасників показало, що фінеренон не впливає на реполяризацію міокарда. Не було жодних ознак впливу фінеренону на подовження інтервалу QT/QTc після прийому одноразових доз 20 мг (терапевтичних) або 80 мг (супратерапевтичних).
Клінічна ефективність та безпека
У ході досліджень FIDELIO-DKD та FIGARO-DKD вивчали вплив фінеренону порівняно з плацебо на ниркові та серцево-судинні (СС) показники у дорослих пацієнтів із ХХН та ЦД2.
Пацієнти отримували стандартне лікування, зокрема максимальну переносиму дозу інгібітора ангіотензинперетворюючого ферменту (іАПФ) або блокатора рецепторів ангіотензину (БРА).
Пацієнти з діагностованою серцевою недостатністю зі зниженою фракцією викиду (II–IV функціональні класи за класифікацією Нью-Йоркської асоціації серця (NYHA)) були виключені з дослідження у зв’язку з рекомендацією для класу 1А щодо лікування антагоністами мінералокортикоїдних рецепторів.
У дослідженні FIDELIO-DKD пацієнти включалися за наявності стійкої альбумінурії (> 30 мг/г до 5000 мг/г), ШКФ від 25 до 75 мл/хв/1,73 м2 та рівня калію в сироватці крові ≤ 4,8 ммоль/л під час скринінгу.
Первинною кінцевою точкою дослідження був час до виникнення сукупності подій: першої появи ниркової недостатності (що визначалась як хронічний діаліз або трансплантація нирки, або стійке зниження рШКФ до < 15 мл/хв/1,73 м2 протягом не менше 4 тижнів), стійкого зниження рШКФ на 40 % або більше в порівнянні з вихідним рівнем протягом не менше 4 тижнів або смерті внаслідок ниркової недостатності. Ключовою вторинною кінцевою точкою був час до першого випадку сукупності подій: смерті від СС захворювань, нелетального інфаркту міокарда, нелетального інсульту або госпіталізації з приводу серцевої недостатності.
Загалом 5674 пацієнти були рандомізовані для отримання фінеренону (N = 2833) або плацебо (N = 2841) і включені до аналізу. Середня тривалість спостереження становила 2,6 року. Під час дослідження дозу фінеренону або плацебо можна було скоригувати в межах від 10 мг до 20 мг один раз на добу, головним чином, залежно від концентрації калію в сироватці крові. На 24-му місяці у групі застосування фінеренону 67 % пацієнтів отримували 20 мг один раз на добу, 30 % – 10 мг один раз на добу, а 3 % перервали лікування.
Після закінчення дослідження інформацію про життєвий статус було отримано у 99,7 % пацієнтів. У досліджуваній популяції 63 % становили представники європеоїдної раси, 25 % –азіати і 5 % – негроїдної раси. Середній вік пацієнтів при включенні становив 66 років, 70 % пацієнтів були чоловічої статі. На початковому етапі середня рШКФ становила 44,3 мл/хв/1,73 м2, при цьому 55 % пацієнтів мали рШКФ < 45 мл/хв/1,73 м2, медіана САК становила 852 мг/г, а середній рівень HbA1c становив 7,7 %, 46 % мали атеросклеротичне захворювання СС системи в анамнезі, 30 % — ішемічну хворобу серця, 8 % — серцеву недостатність, середній артеріальний тиск становив 138/76 мм рт. Середня тривалість ЦД2 на початку дослідження становила 16,6 року, а в анамнезі діабетична ретинопатія та діабетична нейропатії спостерігалися відповідно у 47 % та 26 % пацієнтів. На початковому етапі майже всі пацієнти приймали іАПФ (34 %) або БРА (66 %), а 97 % пацієнтів застосовували один або кілька протидіабетичних препаратів (інсулін [64 %], бігуаніди [44 %], агоністи рецепторів глюкагоноподібного пептиду-1 [7 %], інгібітори натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ2) [5 %]). Іншими препаратами, які найчастіше приймали на початку дослідження, були статини (74 %) та блокатори кальцієвих каналів (63 %).
Статистично значуща різниця на користь фінеренону була показана для первинної комбінованої кінцевої точки та ключової вторинної комбінованої кінцевої точки (див. рис. 1/таблицю 1 нижче).
Ефект лікування за первинними і ключовими вторинними кінцевими точками загалом був однаковим у всіх підгрупах, включаючи рШКФ, САК, систолічний артеріальний тиск і HbA1c на вихідному рівні.
У дослідження FIGARO-DKD пацієнтів включали за наявності стійкої альбумінурії з САК від ≥ 30 мг/г до < 300 мг/г та рШКФ від 25 до 90 мл/хв/1,73 м2 або САК від ≥ 300 мг/г та рШКФ ≥ 60 мл/хв/1,73 м2 під час скринінгу, рівень калію в сироватці крові пацієнтів повинен становити ≤ 4,8 ммоль/л.
Первинною кінцевою точкою був час до виникнення подій: першого випадку смерті від СС захворювань, нелетального інфаркту міокарда (ІМ), нелетального інсульту або госпіталізації з приводу серцевої недостатності. Вторинною кінцевою точкою був час до виникнення подій: появи ниркової недостатності, стійкого зниження рШКФ на 40 % або більше порівняно з вихідним рівнем протягом не менш ніж 4 тижнів або смерті внаслідок ниркової недостатності.
Загалом було рандомізовано та включено в аналіз 7352 пацієнти для отримання фінеренону (N = 3686) або плацебо (N = 3666). Середня тривалість спостереження становила 3,4 року. Під час лікування доза фінеренону або плацебо могла бути скоригована в межах від 10 до 20 мг на добу, головним чином, залежно від концентрації калію в сироватці крові. На 24-му місяці у групі застосування фінеренону 82 % пацієнтів отримували 20 мг один раз на добу, 15 % — 10 мг один раз на добу, а 3 % учасників дослідження перервали лікування.
Після закінчення дослідження інформація про життєвий статус була отримана від 99,8 % пацієнтів. У досліджуваній популяції 72 % становили представники європеоїдної раси, 20 % – монголоїдної та 4 % – негроїдної раси. Середній вік пацієнтів при включенні становив 64 роки, 69 % пацієнтів були чоловічої статі. На початковому етапі середнє значення рШКФ становило 67,8 мл/хв/1,73 м2, причому у 62 % пацієнтів рШКФ була ≥ 60 мл/хв/1,73 м2, медіана САК становила 308 мг/г, а середній рівень HbA1c — 7,7 %; 45 % учасників мали в анамнезі атеросклеротичне ураження серцево-судинної системи, 8 % — серцеву недостатність, а середній артеріальний тиск становив 136/77 мм рт. ст. Середня тривалість захворювання на ЦД2 на початку дослідження становила 14,5 року, а діабетична ретинопатія та діабетична невропатія в анамнезі були зареєстровані відповідно у 31 і 28 % пацієнтів. На початковому етапі майже всі пацієнти застосовували інгібітори АПФ (43 %) або БРА (57 %), а 98 % пацієнтів застосовували один або кілька протидіабетичних препаратів (інсулін [54 %], бігуаніди [69 %], агоністи рецепторів глюкагоноподібного пептиду-1 [7 %], іНЗКТГ2 [8 %]). Іншими препаратами, які найчастіше приймали на початку дослідження, були статини (71 %).
Статистично значуща різниця на користь фінеренону була показана для серцево-судинної первинної комбінованої кінцевої точки (див. рисунок 1 і таблицю 2 нижче). Ефект лікування для первинної кінцевої точки був аналогічним у різних підгрупах, зокрема стратифікованих за регіоном, рШКФ, САК, систолічним артеріальним тиском і HbA1c на вихідному рівні.
У групі фінеренону порівняно з плацебо спостерігалася нижча частота досягнення наслідків вторинної комбінованої кінцевої точки у вигляді появи ниркової недостатності, стійкого зниження рШКФ на 40 % і більше або смерті внаслідок ниркової недостатності, однак ця різниця не досягала статистичної значущості (див. таблицю 2 нижче). Ефект лікування для ниркової вторинної комбінованої кінцевої точки був аналогічним для різних підгруп за рШКФ на вихідному рівні, однак для підгрупи пацієнтів із САК < 300 мг/г відносний ризик (ВР) становив 1,16 (95 % довірчий інтервал (ДІ) 0,91; 1,47), а для підгрупи пацієнтів із САК ≥ 300 мг/г ВР становив 0,74 (95 % ДІ 0,62; 0,90).
Додаткові попередньо визначені вторинні кінцеві точки часу до події включено до таблиці 2.
Таблиця 1
Аналіз первинних і вторинних кінцевих точок часу до події (та їхніх окремих компонентів) у дослідженні III фази FIDELIO-DKD
|
Показник
|
Фіріалта* (N = 2833)
|
Плацебо (N = 2841)
|
Лікувальний ефект
|
|
N (%)
|
події/
100 пацієнто-років
|
N (%)
|
події/
100 пацієнто-років
|
Співвідношення ризиків
(95 % ДІ)
|
|
Первинна ниркова комбінована кінцева точка та її компоненти
|
|
Сукупність подій ниркової недостатності, стійкого зниження рШКФ ≥ 40 % або смерті внаслідок ниркової недостатності
|
504 (17,8 %)
|
7,59
|
600 (21,1 %)
|
9,08
|
0,82 (0,73;0,93)
р = 0,0014
|
|
Ниркова недостатність
|
208 (7,3 %)
|
2,99
|
235 (8,3 %)
|
3,39
|
0,87 (0,72; 1,05)
|
|
Стійке зниження рШКФ ≥ 40 %
|
479 (16,9 %)
|
7,21
|
577 (20,3 %)
|
8,73
|
0,81 (0,72; 0,92)
|
|
Смерть внаслідок ниркової недостатності
|
2 (< 0,1 %)
|
-
|
2 (< 0,1 %)
|
-
|
-
|
|
Ключова вторинна СС комбінована кінцева точка та її компоненти
|
|
Сукупність подій смерті внаслідок СС захворювання, нелетального ІМ, нелетального інсульту або госпіталізації внаслідок серцевої недостатності
|
367 (13,0 %)
|
5,11
|
420 (14,8 %)
|
5,92
|
0,86 (0,75; 0,99)
р = 0,0339
|
|
Смерть внаслідок СС захворювання
|
128 (4,5 %)
|
1,69
|
150 (5,3 %)
|
1,99
|
0,86 (0,68; 1,08)
|
|
Нелетальний ІМ
|
70 (2,5 %)
|
0,94
|
87 (3,1 %)
|
1,17
|
0,80 (0,58; 1,09)
|
|
Нелетальний інсульт
|
90 (3,2 %)
|
1,21
|
87 (3,1 %)
|
1,18
|
1,03 (0,76; 1,38)
|
|
Госпіталізація внаслідок серцевої недостатності
|
139 (4,9 %)
|
1,89
|
162 (5,7 %)
|
2,21
|
0,86 (0,68; 1,08)
|
|
Вторинна кінцева точка ефективності
|
|
Смерть з будь-яких причин
|
219 (7,7 %)
|
2,90
|
244 (8,6 %)
|
3,23
|
0,90
(0,75; 1,07)**
|
|
Госпіталізація внаслідок будь-яких причини
|
1 263 (44,6 %)
|
22,56
|
1 321 (46,5 %)
|
23,87
|
0,95
(0,88; 1,02)**
|
|
Сукупність подій ниркової недостатності, стійкого зниження рШКФ ≥ 57 % або смерті внаслідок ниркової недостатності
|
252 (8,9 %)
|
3,64
|
326 (11,5 %)
|
4,74
|
0,76
(0,65; 0,90)**
|
* Терапія із застосуванням 10 або 20 мг один раз на добу на додаток до максимальних переносимих доз інгібіторів АПФ або БРА.
** p не є статистично значущим після коригування на кратність.
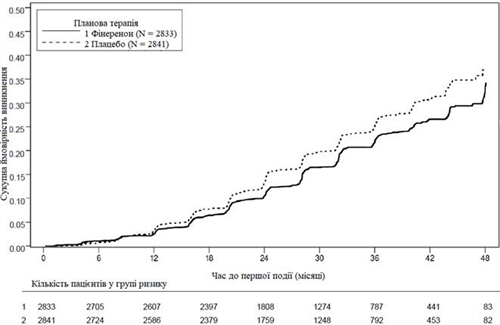
Рис. 1. Час до першого виникнення ниркової недостатності, стійкого зниження рШКФ ≥ 40 % від вихідного рівня або смерті внаслідок ниркової недостатності у дослідженні FIDELIO-DKD.
Таблиця 2
Аналіз первинних і вторинних кінцевих точок часу до події (та їхніх окремих компонентів) у дослідженні III фази FIGAROO-DKD
|
Показник
|
Фіріалта* (N = 3686)
|
Плацебо (N = 3666)
|
Лікувальний ефект
|
|
N (%)
|
події/
100 пацієнто-років
|
N (%)
|
події/
100 пацієнто-років
|
Співвідношення ризиків
(95 % ДІ)
|
|
Первинна СС комбінована кінцева точка та її компоненти
|
|
Сукупність подій смерті внаслідок СС захворювання, нелетального ІМ, нелетального інсульту або госпіталізації внаслідок серцевої недостатності
|
458 (12,4)
|
3,87
|
519 (14,2)
|
4,45
|
0,87 (0,76; 0,98)
p = 0,0264
|
|
Смерть внаслідок СС захворювання
|
194 (5,3)
|
1,56
|
214 (5,8)
|
1,74
|
0,90 (0,74; 1,09)
|
|
Нелетальний ІМ
|
103 (2,8)
|
0,85
|
102 (2.8)
|
0,85
|
0,99 (0,76; 1,31)
|
|
Нелетальний інсульт
|
108 (2,9)
|
0,89
|
111 (3,0)
|
0,92
|
0,97 (0,74; 1,26)
|
|
Госпіталізація внаслідок серцевої недостатності
|
117 (3,2)
|
0,96
|
163 (4,4)
|
1,36
|
0,71 (0,56; 0,90)
|
|
Вторинна ниркова комбінована кінцева точка та її компоненти
|
|
Сукупність подій ниркової недостатності, стійкого зниження рШКФ ≥ 40 % або смерті внаслідок ниркової недостатності
|
350 (9,5)
|
3,15
|
395 (10,8)
|
3,58
|
0,87 (0,76; 1,01) p = 0,0689 **
|
|
Ниркова недостатність
|
46 (1,2)
|
0,40
|
62 (1,7)
|
0,54
|
0,72 (0,49;1,05)
|
|
Стійке зниження рШКФ ≥ 40 %
|
338 (9,2)
|
3,04
|
385 (10,5)
|
3,49
|
0,87 (0,75; > 1,00)
|
|
Смерть внаслідок ниркової недостатності
|
0
|
-
|
2 (< 0,1)
|
-
|
-
|
|
Вторинна кінцева точка ефективності
|
|
Смерть з будь-яких причин
|
333 (9,0)
|
2,68
|
370 (10,1)
|
3,01
|
0,89 (0,77; 1,04)**
|
|
Госпіталізація внаслідок будь-яких причини
|
1573 (42,7)
|
16,91
|
1605 (43,8)
|
17,52
|
0,97 (0,90; 1,04)**
|
|
Сукупність подій ниркової недостатності, стійкого зниження рШКФ ≥ 57 % або смерті внаслідок ниркової недостатності
|
108 (2,9)
|
0,95
|
139 (3,8)
|
1,23
|
0,77 (0,60; 0,99)**
|
* Терапія із застосуванням 10 або 20 мг один раз на добу на додаток до максимальних переносимих доз інгібіторів АПФ або БРА.
** p не є статистично значущим після коригування на кратність.
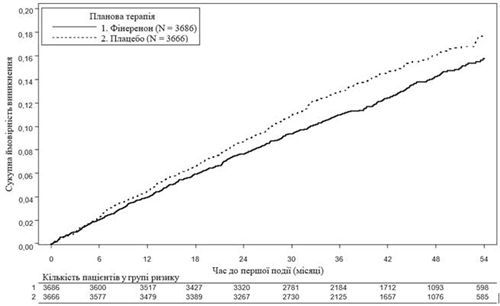
Рис. 2. Час до першого випадку смерті від СС захворювань, нелетального ІМ, нелетального інсульту або госпіталізації внаслідок серцевої недостатності у дослідженні FIGARO-DKD.
Педіатричні пацієнти
Європейська агенція з лікарських засобів відклала зобов’язання щодо представлення результатів досліджень препарату Фіріалта в одній або декількох підгрупах педіатричної популяції при лікуванні хронічної хвороби нирок (для отримання інформації щодо застосування в педіатрії див.«Спосіб застосування та дози»).
Фармакокінетика.
Абсорбція
Фінеренон майже повністю всмоктується після перорального прийому. Всмоктування відбувається швидко, максимальна концентрація в плазмі (Cₘₐₓ) досягається через 0,5–1,25 години після прийому таблетки натще. Абсолютна біодоступність фінеренону становить 43,5 % завдяки метаболізму першого проходження в стінках кишечнику та печінці. Фінеренон in vitro є субстратом транспортера відтоку Р-глікопротеїну, який, однак, не вважається релевантним для його поглинання in vivo через високу проникність фінеренону.
Вплив прийому їжі. Прийом їжі з високим вмістом жирів і високої калорійності підвищував AUC фінеренону на 21 %, зменшував Cₘₐₓ на 19 % і подовжував час досягнення Cₘₐₓ до 2,5 години. Оскільки це не вважається клінічно значущим, фінеренон можна приймати незалежно від прийому їжі.
Розподіл
Об’єм розподілу в рівноважному стані (Vₛₛ) фінеренону становить 52,6 л. Зв’язування фінеренону з білками плазми крові людини in vitro становить 91,7 %, при цьому сироватковий альбумін є основним зв’язуючим білком.
Біотрансформація
Приблизно 90 % метаболізму фінеренону опосередковується CYP3A4 і 10 % - CYP2C8. У плазмі було виявлено чотири основних метаболіти. Усі метаболіти фармакологічно неактивні.
Виведення
Виведення фінеренону з плазми відбувається швидко, період напіввиведення (t½) становить приблизно від 2 до 3 годин. Системний кліренс фінеренону в крові становить приблизно 25 л/год. Близько 80 % введеної дози виводилося із сечею і приблизно 20 % - з калом. Виведення відбувалося майже виключно у формі метаболітів, тоді як екскреція незміненого фінеренону є другорядним шляхом (< 1 % дози - з сечею внаслідок клубочкової фільтрації, < 0,2 % - з калом).
Лінійність
Фармакокінетика фінеренону є лінійною у дослідженому діапазоні доз від 1,25 до 80 мг таблеток, призначених у однократному дозуванні.
Особливі групи пацієнтів
Пацієнти літнього віку. З 2827 пацієнтів, які отримували фінеренон у дослідженні FIDELIO-DKD, 58 % були віком від 65 років, а 15 % – від 75 років. З 3683 пацієнтів, які отримували фінеренон у дослідженні FIGARO-DKD, 52 % були віком від 65 років, а 13 % – від 75 років. Загалом відмінностей у безпеці чи ефективності фінеренону у цих пацієнтів та пацієнтів молодшого віку не спостерігалося в обох дослідженнях.
У дослідженні I фази (N = 48) здорові учасники літнього віку (≥ 65 років) мали вищі концентрації фінеренону в плазмі, ніж молодші здорові учасники (≤ 45 років), при цьому середні значення AUC і Cₘₐₓ були на 34 % і 51 % вищими у пацієнтів літнього віку (див. розділ «Спосіб застосування та дози»). Популяційно-фармакокінетичний аналіз не визначив вік як коваріату для AUC або Cₘₐₓ фінеренону.
Порушення функції нирок. Порушення функції нирок легкого ступеня (кліренс креатиніну (КлКр) від 60 до < 90 мл/хв) не впливав на AUC та Cₘₐₓ фінеренону. У порівнянні з пацієнтами з нормальною функцією нирок (КлКр ≥ 90 мл/хв) вплив ниркової недостатності помірного (КлКр від 30 до < 60 мл/хв) та тяжкого (КлКр < 30 мл/хв) ступеня на AUC фінеренону був подібним,зі збільшенням на 34–36 %. Порушення функції нирок помірного або тяжкого ступеня не впливало на Cₘₐₓ (див. розділ «Спосіб застосування та дози»).
Через високий рівень зв’язування з білками плазми не очікується, що фінеренон підлягає діалізу.
Порушення функції печінки. Експозиція фінеренону у пацієнтів з цирозом і легким ураженням печінки не змінювалася (див. розділ «Спосіб застосування та дози»).
У пацієнтів з цирозом печінки з помірним ступенем порушення функції печінки порівняно зі здоровими учасниками контрольної групи загальна AUC фінеренону та AUC незв’язаного фінеренону збільшувалися на 38 % та 55 % відповідно, тоді як змін Cₘₐₓ не спостерігалося (див. розділ «Спосіб застосування та дози»).
Даних щодо пацієнтів із тяжким ступенем порушення функції печінки немає (див. розділи «Спосіб застосування та дози» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Маса тіла. Популяційно-фармакокінетичний аналіз визначив масу тіла як коваріату для Cₘₐₓ фінеренону. У пацієнта з масою тіла 50 кг порівняно з пацієнтом, маса тіла якого 100 кг, Cₘₐₓ оцінюється як вища на 38–51 %. Корекція дози залежно від маси тіла не є виправданою (див. розділ «Спосіб застосування та дози»).
Фармакокінетичні/фармакодинамічні взаємозв’язки
Взаємозв’язок «концентрація–ефект» для показника співвідношення альбуміну і креатиніну в сечі (САК) залежно від часу було охарактеризовано моделлю максимального ефекту, що вказує на насичення при високій експозиції. Прогнозований моделлю час досягнення повного (99 %) ефекту лікарського засобу у рівноважному стані на САК становив 138 днів. Фармакокінетичний (ФК) період напіввиведення становив 2–3 години, а ФК рівноважний стан досягався через 2 дні, що вказує на непрямий та відстрочений вплив на фармакодинамічні ефекти.
Клінічні дослідження без суттєвих взаємодій між лікарськими засобами
Одночасне застосування гемфіброзилу (600 мг двічі на добу), сильного інгібітора CYP2C8, підвищувало середню AUC і Cₘₐₓ фінеренону в 1,1 та 1,2 раза відповідно. Це не вважається клінічно значущим.
Попередня та супутня терапії інгібітором протонної помпи омепразолом (40 мг один раз на добу) не впливали на середню AUC та середню Cₘₐₓ фінеренону.
Одночасне застосування антациду гідроксиду алюмінію та гідроксиду магнію (70 мВал) не впливало на середню AUC фінеренону та знижувало середнє значення Cₘₐₓ на 19 %. Це не вважається клінічно значущим.
In vivo режим багаторазового прийому 20 мг фінеренону один раз на добу протягом 10 днів суттєво не впливав на AUC субстрату CYP3A4 мідазоламу. Таким чином, можна виключити клінічно значуще пригнічення або індукцію CYP3A4 фінереноном.
Одноразова доза 20 мг фінеренону також не мала клінічно значущого впливу на AUC та Cₘₐₓ репаглініду, субстрату CYP2C8. Отже, фінеренон не пригнічує CYP2C8.
Було продемонстровано відсутність фармакокінетичної взаємодії між фінереноном та субстратом CYP2C9 варфарином та між фінереноном та субстратом P-gp дигоксином.
Багаторазові дози фінеренону 40 мг один раз на добу не мали клінічно значущого впливу на AUC і Cₘₐₓ розувастатину, субстрату білка резистентності раку молочної залози та органічного аніонтранспортного поліпептиду.
Доклінічні дані з безпеки
Доклінічні дані не виявили особливого ризику для людини на основі загальноприйнятих досліджень фармакологічної безпеки, токсичності разової дози, токсичності повторних доз, генотоксичності, фототоксичності, канцерогенного потенціалу та впливу на фертильність у чоловіків та жінок.
Медикаменти
БАДи і Вітаміни
Медичні товари
Антибіотики
Товари для мам і дітей
Косметика та гігієна